Zakład Żywienia Zwierząt

Kierownik Zakładu
dr hab. Barbara Kowalik, profesor instytutu
🖂 b.kowalik@ifzz.pl
Pracownicy naukowi
prof. dr hab. Marian Czauderna, 🖂 m.czauderna@ifzz.pl
dr hab. Grzegorz Bełżecki, profesor instytutu, 🖂 g.belzecki@ifzz.pl
dr hab. inż. Małgorzata Białek, profesor instytutu, 🖂 m.bialek@ifzz.pl
dr hab. inż. Paweł Konieczka, prof. UWM, 🖂 p.konieczka@ifzz.pl
dr hab. Paweł Kowalczyk, 🖂 p.kowalczyk@ifzz.pl
dr hab. Renata Miltko, profesor instytutu, 🖂 r.miltko@ifzz.pl
dr hab. Grzegorz Skiba, profesor instytutu, 🖂 g.skiba@ifzz.pl
dr hab. Ewa Święch, profesor instytutu, 🖂 e.swiech@ifzz.pl
dr hab. Anna Tuśnio, profesor instytutu, 🖂 a.tusnio@ifzz.pl
dr inż. Marcin Barszcz, 🖂 m.barszcz@ifzz.pl
dr Małgorzata Majewska, 🖂 m.majewska@ifzz.pl
dr inż. Monika Sobol, 🖂 m.sobol@ifzz.pl
mgr Kamil Gawin, 🖂 k.gawin@ifzz.pl
mgr Misza Kinsner, 🖂 m.kinsner@ifzz.pl
mgr Adrianna Konopka, 🖂 a.konopka@ifzz.pl
mgr Wiktoria Wojtak, 🖂 w.wojtak@ifzz.pl
Pracownik badawczo-techniczny
dr hab. Agnieszka Białek 🖂 a.bialek@ifzz.pl
Pracownicy inżynieryjni
inż. Natalia Frączek, 🖂 n.fraczek@ifzz.pl
mgr Aneta Kędzierska, 🖂 a.kedzierska@ifzz.pl
mgr inż. Urszula Wolska-Świętlicka, 🖂 u.wolska-swietlicka@ifzz.pl
Pracownicy techniczni
Malwina Krakowiak, 🖂 m.krakowiak@ifzz.pl

Aktualna tematyka badawcza
W Zakładzie prowadzone są badania głównie na: drobiu, trzodzie chlewnej, przeżuwaczach oraz na zwierzętach laboratoryjnych i mikroorganizmach zasiedlających przedżołądki zwierząt przeżuwających.
- Identyfikacja i charakterystyka drobnoustrojów zasiedlających przewód pokarmowy ptaków i ssaków.
- Izolacja i hodowla mikroorganizmów w warunkach in vitro.
- Określenie zmian jakościowych i ilościowych symbiotycznej mikroflory i mikrofauny pod wpływem bioaktywnych składników pokarmu.
- Rola orzęsków żwaczowych w procesach metanogenzy i gospodarki lipidowej.
- Izolacja i charakterystyka enzymów pochodzenia mikrobiologicznego katalizujących trawienie węglowodanów zapasowych i strukturalnych (pochodzenia roślinnego i mikrobiologicznego) w żwaczu.
- Określenie wpływu dodatków paszowych na wskaźniki procesów trawiennych oraz wyniki produkcyjne i jakość mięsa oraz na rozkład składników pokarmowych pasz metodą in sacco.
- Wykorzystanie metod in vitro w badaniach strawności składników pokarmowych i aktywności flory bakteryjnej.
- Wykorzystanie krajowych źródeł białka w żywieniu ptaków i ssaków.
- Wpływ procesów technologicznych na wartość odżywczą nasion roślin bobowatych.
- Badania nad wpływem włókna pokarmowego na fizjologię przewodu pokarmowego.
- Rola czynników żywieniowych na właściwości kości rosnących zwierząt.
- Wpływ związków bioaktywnych na układ odpornościowy przewodu pokarmowego zwierząt monogastrycznych i przeżuwających.
- Wpływ diety w zapobieganiu występowania stresu oksydacyjnego w organizmach zwierząt.
- Wpływ olejów oraz antyutleniaczy na profil kwasów tłuszczowych, aminokwasów, status antyoksydacyjny i zawartość cholesterolu w wybranych tkankach i narządach zwierząt.
- Wpływ dodatku izomerów CLA do diety matek z chorobą nowotworową na stan zdrowia potomstwa – badania na modelu szczura (programowanie żywieniowe).

Najważniejsze osiągnięcia
- Identyfikacja i charakterystyka nowego gatunku bakterii Treponema zioleckii oraz opracowanie metody określania biomasy bakterii na podstawie zawartości mureiny (Piknova i wsp., 2008. FEMS Microbiol. Lett. 289, 166-172; Bełżecki i wsp., 2012. J. Anim. Feed Sci. 21, 624-634).
- Wykazano, że orzęski żwaczowe mogą być wykorzystywane, jako potencjalne źródło wodoru w ogniwach paliwowych służących do pozyskiwania energii elektrycznej oraz, że dysponują one kompletem enzymów zdolnych do rozkładu węglowodanów, w tym chityny (Piela i wsp., 2010.
J. Microbiol. Biotechnol. 20, 1092-1100; Miltko i wsp., 2015. J. Anim. Feed Sci. 24, 203-207; Miltko i wsp., 2016. Arch Anim Nutr. 70, 425-440). - Wykazano, że dodatek kory dębu (Quercus sp.) do dawek pokarmowych dla owiec zwiększa ogólną liczebność pierwotniaków w żwaczu oraz, że stymuluje aktywność zewnątrz-wydzielniczą trzustki. Ponadto wykazano, że liście borówki (Vaccinium vitis idaea L.) stosowane w dawkach pokarmowych dla jagniąt poprawiają jakość mięsa (Majewska i wsp., 2021. Anim. Biosci. 34, 1146-1156; Majewska i wsp., 2017. J. Anim. Feed Sci. 26, 354-358; Majewska i Kowalik, 2020. Eur. J. Lipid Sci. Tech. 122, 1900273).
- Wykazano, że dodatek olejów roślinnych o wysokiej zawartości kwasu α-linolenowego (olej lniany) i oleinowego (olej rzepakowy) w dawkach pokarmowych dla owiec istotnie zmniejsza rozkład celulozy. Stwierdzono również, że olej rzepakowy negatywnie wpływa na aktywność pektynolityczną w żwaczu owiec. Ponadto, wykazano, że zastosowane oleje zwiększają aktywność lipazy trzustkowej oraz, że olej lniany bardziej niż olej rzepakowy poprawia jakość jagnięciny (Majewska i wsp., 2020. Livest. Sci. 240, 104175; Kowalik i wsp., 2018. J. Anim. Physiol. Anim. Nutr. 102, 1194-1198; Miltko i wsp., 2019. Asian-Austral. J. Anim. Sci. 32, 767-775).
- Wykazano, że kwas karnozynowy i selenian (VI) dodane do dawek pokarmowych zmniejszają biosyntezę CH4 i CO2 w żwaczu owiec oraz, że poprawiają wykorzystanie paszy przez jagnięta. Ponadto, stwierdzono, że zastosowanie selenianu (IV) zmniejsza biouwodornienie nienasyconych kwasów tłuszczowych w żwaczu owiec (Białek i Czauderna, 2019. Livest. Sci. 226, 122-132; Miltko i wsp., 2016. Acta Vet.-Beograd 66, 373-391; Białek i wsp., 2020. Livest. Sci. 241, 104249).
- Wykazano, że dodanie do diety jagniąt oleju rybnego w połączeniu z kwasem karnozynowym i organicznym selenem zwiększa gęstość oraz poprawia właściwości biomechaniczne kości (Skiba i wsp., 2021. Animals 11, 230).
- Wykazano, że fruktany typu inulinowego mogą przyczyniać się do poprawy dobrostanu prosiąt przez zwiększanie populacji bakterii z rodzaju Bifidobacterium, działanie antyoksyacyjne oraz korzystne zmiany ekspresji białek w błonie śluzowej jelita grubego świń. Wskazuje to na korzystny wpływ na funkcjonowanie bariery jelitowej, ochronę przed endotoksynami i wolnymi rodnikami, a tym samym na możliwość stosowania inuliny w dietoprofilaktyce chorób jelita grubego (Barszcz i wsp., 2016. Arch. Anim. Nutr. 70, 278-292; Barszcz i wsp., 2018. Anim. Prod. Sci. 58, 1109-1118; Herosimczyk i wsp., 2020. Animal 14, 1647-1658).
- Wykazano, że dodatek glicynianu cynku do paszy dla prosiąt sprzyja rozwojowi populacji Clostridium herbivorans, a dodatek włókna ziemniaczanego zwiększa aktywność bakteryjnej β-glukozydazy w jelicie grubym, co przyczynia się do zwiększenia strawności włókna pokarmowego (Barszcz i wsp., 2019. Livest. Sci. 227, 37-43; Barszcz i wsp., 2021. Livest. Sci., 245, 104429).
- Wykazano, że zarówno wysoki poziom łubinu wąskolistnego w paszy, jak i proces mikronizacji mogą mieć negatywny wpływ na skład i aktywność mikroflory jelita grubego prosiąt. Ponadto stwierdzono, że wysoki poziom łubinu w mieszankach może mieć niekorzystny wpływ na przyrost masy ciała prosiąt (Tuśnio i wsp., 2020. Livest. Sci. 240, 104137).
- Wykazano, że interakcje pomiędzy źródłem białka a źródłem węglowodanów
w paszy, wpływają na aktywność flory bakteryjnej jelita grubego świń. Modyfikacja fermentacji proteolitycznej za pomocą węglowodanów złożonych jest możliwa, lecz kierunek tych zmian zależy od rodzaju węglowodanów. Surowa skrobia ziemniaczana pogłębia negatywny wpływ białka gorzej trawionego w jelicie cienkim, natomiast pektyna i celuloza zmniejszają intensywność bakteryjnej proteolizy (Taciak i wsp., 2017. Arch. Anim. Nutr. 71, 192-209). - Wykazano, że dodatek inuliny redukuje negatywny wpływ wysokotłuszczowej diety bogatej w nasycone kwasy tłuszczowe na właściwości kości rosnących świń oraz cechy prozdrowotne i technologiczne mięsa wieprzowego oraz określono zależności między proporcją n-6/n-3 PUFA w paszy i ciele a właściwościami kości rosnących świń (Sobol i wsp., 2018. Br. J. Nutr., 119: 1111-1118; Przybylski i wsp., 2019. J. Anim. Physiol. Anim. Nutr., 103, 593-602; Sobol i wsp., 2019. Br. J. Nutr., 121, 508–518).
- Wykazano, że niska proporcja kwasów PUFA n-6/n-3 oraz zwiększona dawka witaminy E w diecie kurcząt powodują uszkodzenia DNA komórek nabłonka jelit oraz negatywnie oddziałuje na jego mikrostrukturę. Ponadto, wykazano, że zwiększenie w czasie odchowu zawartości witaminy E
w paszy powoduje oporność kurcząt brojlerów z indukowanym stanem zapalnym na działanie kwasu acetylosalicylowego. Przeprowadzona po raz pierwszy u drobiu analiza zużycia tlenu przez mitochondria płytek krwi udowodniła, że podanie kwasu acetylosalicylowego nie wpływa negatywnie na funkcję mitochondriów, a wręcz przeciwnie, może przeciwdziałać negatywnym skutkom stanu zapalnego (Konieczka i wsp., 2018. Poult. Sci. J., 97, 149-158; Konieczka i wsp., 2019. Vet. Res. 50, ID 65). - Wykazano, że nano selen (Nano-Se) oraz ekstrakt z konopi siewnych (Cannabis sativa L.) stosowane w żywieniu kurcząt brojlerów mogą wspierać funkcje bariery jelitowej u ptaków narażonych na infekcję bakteriami C. perfringens, które są odpowiedzialne za wywoływanie martwiczego zapalenia jelit u drobiu (Konieczka i wsp., 2020. Vet. Res. 51, ID 141).
- Wykazano, że w sercach szczurów z indukowanym nowotworem sutka, izomery CLA zawarte w dietach, wpływają hamująco na peroksydację wielonienasyconych kwasów tłuszczowych oraz obniżają poziom aterogennych nasyconych kwasów tłuszczowych i zmniejszają utlenianie cholesterolu (Białek i wsp., 2019, Nutrients 11, 2032; Białek i wsp., 2020, Animals 10, 464).
- Wykazano, że olej z nasion granatowca właściwego powoduje zmiany w składzie i zawartości kwasów tłuszczowych, obniża aktywność desaturaz i ogranicza powstawanie produktów oksydacji lipidów w wątrobie szczurów (Białek i wsp., 2017. Prostagland. Other Lipid Mediat. 131, 9-16).
- Wykazano, że pochodne kumaryny, 1.2 alfa-aminoamidy, diaryloetanole oraz δ-lactony działają toksycznie na komórki bakteryjne E. coli K12, R1-R4 występujące w przewodzie pokarmowym. Związki te, indukują w komórkach bakterii patogennych stres oksydacyjny i hamują ich replikację. Stwierdzono również, że badane związki charakteryzują się większą skutecznością i selektywnością względem określonych szczepów bakteryjnych E.coli, jednocześnie wykazując większą stabilność biologiczną oraz toksyczność dla organizmu człowieka w porównaniu do tradycyjnie stosowanych antybiotyków (Kowalczyk i wsp., 2020. Materials 13, 2499; Kowalczyk i wsp., 2020. Materials 13, 5169; Kowalczyk i wsp., 2021. Materials 14, 1025; Kowalczyk i wsp., 2021. Materials 14, 2956).
Wybrane publikacje
Czauderna M., Wojtak W., Białek M., Białek A. 2024. Optimization of high-efficient pre-column sample treatments and C18-UFLC method for selective quantification of selected chemical forms of tocopherol and tocotrienol in diverse foods. Food Chemistry 437, 137909; https://doi.org/10.1016/j.foodchem.2023.137909; 200 pkt.; IF = 8,8; Q1
Barszcz M., Gawin K., Tuśnio A., Konopka A., Święch E., Taciak M., Skomiał J., Tokarčiková K., Čobanová K., Grešáková L. 2023. Comparison between organic and inorganic zinc forms and their combinations with various dietary fibers in respect of the effects on electrolyte concentrations and mucosa in the large intestine of pigs. International Journal of Molecular Sciences 24, 16743; https://doi.org/10.3390/ijms242316743; 140 pkt., IF 5,6; Q1
Czauderna M., Karpińska M., Woliński J., Zaworski K., Białek M., Pierzynowski S., Wojtak W., Pierzynowska K. 2023. Improved lipid saponification method for chromatographic quantification of fatty acids in pig erythrocytes – an important lipidomic biomarker of effectiveness of dietary fat supplementation for pigs used as large animal model for human studies. Journal of Animal and Feed Sciences 32 (4), 385-399; https://doi.org/10.22358/jafs/163632/2023; 100 pkt.; IF = 1,0; Q3
Konieczka P., Ferenc K., Jørgensen J.N., Hansen L.H.B., Zabielski R., Olszewski J., Gajewski Z., Mazur-Kuśnirek M., Szkopek D., Szyryńska N., Lipiński K. 2023. Feeding Bacillus-based probiotics to gestating and lactating sows is an efficient method for improving immunity, gut functional status and biofilm formation by probiotic bacteria in piglets at weaning. Animal Nutrition 13, 361-372; https://doi.org/10.1016/j.aninu.2023.03.003; 100 pkt.; IF=6,30; Q=1
- Koszelewski D., Kowalczyk, P., Brodzka A., Hrunyk A., Kramkowski K., Ostaszewski R. 2023. Enzymatic synthesis of a novel coumarin aminophosphonates: Antibacterial effects and oxidative stress modulation on selected E. coli strains. International Journal of Molecular Sciences 24, 7609; https://doi.org/10.3390/ijms24087609; 140 pkt; IF 5,60; Q1
Kowalczyk P., Koszelewski D., Brodzka A., Kramkowski K., Ostaszewski R. 2023. Evaluation of antibacterial activity against nosocomial pathogens of an enzymatically derived α-aminophosphonates possessing coumarin Scaffold. International Journal of Molecular Sciences 24, 14886; https://doi.org/10.3390/ijms241914886; 140 pkt; IF 5,60; Q1
Maculewicz E., Pabin A., Dziuda Ł., Białek M., Białek A. 2023. Selected exogenous (occupational and environmental) risk factors of cardiovascular diseases in military and aviation. Journal of Clinical Medicine 12 (23), 7492; https://doi.org/10.3390/jcm12237492; 140 pkt.; IF 3,9; Q2
Majewska M.P., Miltko R., Bełżecki G., Kędzierska A., Kowalik B. 2023. Rumen protozoa population and carbohydrate-digesting enzymes in sheep fed a diet supplemented with hydrolysable tannins. Annals of Animal Science 23 (2) 561-570; https://doi.org/10.2478/aoas-2022-0095; 200 pkt.; IF 1.9; Q2
Konieczka P., Szkopek D., Kinsner M., Kowalczyk P., Michalczuk M., Bień D., Banach J., Matusevičius P., Bogucka J. 2022. Cannabidiol and nano-selenium Increase microvascularization and reduce degenerative changes in superficial breast muscle in C. perfringens-infected chickens. International Journal of Molecular Science 24, 237; https://doi.org/10.3390/ijms24010237; 140 pkt.; IF 5,60; Q1
Konieczka P., Wojtasik-Kalinowska I., Poltorak A., Kinsner M., Szkopek D., Fotschki B., Juśkiewicz J., Banach J., Michalczuk M. 2022. Cannabidiol affects breast meat volatile compounds in chickens subjected to different infection models. Scientific Reports 12, 18940; https://doi.org/10.1038/s41598-022-23591-1; 140 pkt.; IF 4,60; Q1
Konieczka P., Żelechowska E., Przybylski W., Jaworska D., Sałek P., Kinsner M., Jankowski J. 2022. The sarcoplasmic protein profile of breast muscle in Turkeys in response to different dietary ratios of limiting amino acids and Clostridium perfringens-induced inflammation. Poultry Science 101, 102195; https://doi.org/10.1016/j.psj.2022.102195; 140 pkt.; IF 4,40; Q1
Lepionka T., Białek M., Czauderna M., Szlis M., Białek A., 2022., Lipidomic profile and enzymes activity in hepatic microsomes of rats in physiological and pathological conditions. International Journal of Molecular Sciences. 23, 422; https://10.3390/ijms23010442; 140 pkt; IF=6,208; Q1
Sobol M., Skiba G., Raj S., Kowalczyk P., Kramkowski K., Świątkiewicz M., Grela E.R. 2022. Chemical body composition and bone growth of young pigs as affected by deficient, adequate and excess dietary phosphorus supply. Annals of Animal Science 22 (4),
1363–1372; https://doi.org/10.2478/aoas-2022-0061; 200 pkt.; IF 1.9; Q2Święch E., Tuśnio A., Taciak M., Barszcz M. 2022. Modulation of mucin secretion in the gut of young pigs by dietary threonine and non-essential amino acid levels. Animals 12, 270; https://doi.org/10.3390/ani12030270; 100 pkt.; IF 3,0; Q1
- Lepczyński A., Herosimczyk A., Barszcz M., Ożgo M., Michałek K., Grabowska M., Tuśnio A., Szczerbińska D., Skomiał J. 2021. Diet supplemented either with dried chicory root or chicory inulin significantly influence kidney and liver mineral content and antioxidative capacity in growing pigs. Animal 15, 100129; https://doi.org/10.1016/j.animal.2020.100129; 200 pkt.; IF 3,7; Q1
Maculewicz E., Pabin A., Dziuda Ł., Białek M., Białek A. 2023. Selected exogenous (occupational and environmental) risk factors of cardiovascular diseases in military and aviation. Journal of Clinical Medicine 12 (23), 7492; https://doi.org/10.3390/jcm12237492; 140 pkt.; IF 3,9; Q2
- Majewska M.P., Miltko R., Bełżecki G., Kowalik B. 2021. Population of protozoa and carbohydrate-digesting enzymes in the rumen of sheep fed a diet supplemented with yeast Saccharomyces cerevisiae. Small Ruminant Research 205, 106544; https://doi.org/10.1016/j.smallrumres.2021.106544; 100 pkt; IF 1.8; Q2
Skiba G., Raj S., Sobol M., Kowalczyk P., Grela E.R. 2021. Role of polyphenols in the metabolism of the skeletal system in humans and animals – A Review. Annals of Animal Science 21 (4), 1275–1300; https://doi.org/10.2478/aoas-2021-0040; 200 pkt; IF 1.9; Q2
Tuśnio A., Barszcz M., Święch E., Skomiał J., Taciak M. 2020. Large intestine morphology and microflora activity in piglets fed diets with two levels of raw or micronized blue sweet lupin seeds. Livesock Science 240, 104137; https://doi.org/10.1016/j.livsci.2020.104137; 140 pkt.; IF 1,8; Q1
Laboratorium Analizy Bariery Ochronnej Przewodu Pokarmowego


Kierownik Laboratorium
dr inż. Marcin Barszcz
🖂 m.barszcz@ifzz.pl
Laboratorium Analizy Bariery Ochronnej Przewodu Pokarmowego jest nową jednostką organizacyjną Zakładu Żywienia Zwierząt utworzoną w 2018 roku dzięki funduszom przyznanym przez Ministerstwo Nauki i Szkolnictwa Wyższego w ramach wniosku na finansowanie kosztów restrukturyzacji Instytutu w latach 2018-2019.
Tematyka badawcza
- Laboratorium prowadzi badania nad układem odpornościowym przewodu pokarmowego zwierząt gospodarskich i laboratoryjnych.
- Celem badań jest określenie wpływu żywienia (diety, składników pokarmowych, związków bioaktywnych) na odporność wrodzoną
i nabytą przewodu pokarmowego, a także roli mikrobioty jelitowej w kształtowaniu funkcji barierowej. - Laboratorium wykonuje analizy materiału biologicznego (tkanki, płyny ustrojowe i in.) na zlecenie i jest otwarte na współpracę z krajowymi
i zagranicznymi jednostkami naukowymi oraz innymi podmiotami.
Zakres usług oferowanych przez Laboratorium
- Laboratorium dysponuje szerokim zakresem metod analitycznych, umożliwiających oznaczanie parametrów specyficznych dla bariery ochronnej przewodu pokarmowego i funkcjonowania układu odpornościowego.
- Posiadana aparatura umożliwia również wykonywanie analiz niezwiązanych ze specyfiką Laboratorium.
- W celu przygotowania materiału biologicznego do badań oraz w większości analiz wykonywanych w Laboratorium wykorzystywana jest również
inna aparatura naukowo-badawcza Zakładu Żywienia Zwierząt.
Rodzaj próbek
- tkanki zwierzęce, homogenaty, supernatanty
- zawiesiny komórek
- płyny ustrojowe
- w zależności od analizy do Laboratorium mogą być przyjmowane próbki świeże lub mrożone.
Analizy
Cytometr przepływowy BD FACSCelesta:
- subpopulacje komórek układu odpornościowego (izolowane z przewodu pokarmowego i krwi)
- funkcje granulocytów i monocytów:
− fagocytoza
− wybuch
− tlenowy inne
Spektrofluorymetr SpectraMax iD3
- stężenie mucyn
- stężenie wydzielniczej immunoglobuliny A oraz innych przeciwciał i białek (ELISA)
- aktywność enzymów antyoksydacyjnych
- inne analizy mikropłytkowe oparte na pomiarach absorbancji, fluorescencji i luminescencji
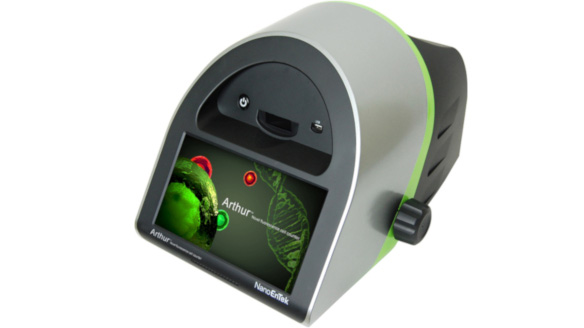
Licznik komórek Arthur:
- liczba komórek w zawiesinie (standaryzacja do cytometrii przepływowej i innych analiz)
- żywotność komórek (metoda z jodkiem propidyny)
- cykl komórkowy (metoda z jodkiem propidyny)
- apoptoza (metoda z aneksyną V i jodkiem propidyny)
- ekspresja białka zielonej fluorescencji (GFP)
Termocykler MIC:
- ekspresja genów kodujących m.in. mucyny, cytokiny, białka transportujące, microRNA
Analiza histologiczna
- obróbka chemiczna i zatapianie materiału biologicznego w bloczkach parafinowych
- cięcie materiału biologicznego zatopionego w bloczkach parafinowych (mikrotom rotacyjny HM355S)
- barwienie preparatów histologicznych:
− hematoksylina-eozyna (HE)
− floksyna-tartrazyna (FT)
− alcjan błękitu-kwas nadjodowy-odczynnik Schiffa (AB-PAS)
− błękit toluidyny (TB)
Analiza preparatów pod mikroskopem:
- liczba limfocytów śródnabłonkowych w jelicie cienkim i grubym świń (HE)
- liczba komórek tucznych (TB)
- liczba i rodzaj komórek kubkowych (AB-PAS)
- liczba komórek Panetha w jelicie cienkim gryzoni laboratoryjnych (FT).
Oferta Laboratorium wkrótce zostanie rozszerzona o inne metody analityczne, które są aktualnie opracowywane i wdrażane.
Wyposażenie
CYTOMETR PRZEPŁYWOWY BD FACSCelesta
Cyfrowy cytometr przepływowy BD FACSCelesta (Becton Dickinson, Franklin Lakes, New Jersey, USA) umożliwiający jednoczesny pomiar 12 fluorescencji na jednej komórce, wyposażony w 3 lasery (niebieski, czerwony, fioletowy), podajnik próbek z płytek wielodołkowych oraz moduł FACS Flow Supply System do podawania płynu roboczego ze zbiornika 20 l i odprowadzania ścieków. Stosowany w badaniach z zakresu immunologii (m.in. populacje komórek, testy fagocytozy, wybuch tlenowy), biologii komórki (m.in. apoptoza, cykl komórkowy) i in.


SPEKTROFLUORYMETR SPECTRAMAX ID3
Wielofunkcyjny czytnik płytek SpectraMax iD3 (Molecular Devices, San Jose, California, USA) umożliwiający odczyty absorbancji, fluorescencji (z góry i z dołu), luminescencji oraz pomiary kinetyczne. Posiada termostatowaną komorę pomiarową z możliwością regulacji temperatury (od 5°C powyżej temperatury otoczenia do 66°C) oraz wytrząsania płytki. Wykorzystywany do analiz biochemicznych, testów immuno-enzymatycznych (ELISA) i in.
AUTOMATYCZNY LICZNIK KOMÓREK ARTHUR
Automatyczny, fluorescencyjny licznik komórek Arthur (NanoEnTek, Seul, Korea Południowa) to 3-kanałowy licznik (jasne pole, zielona fluorescencja, czerwona fluorescencja) umożliwiający szybką analizę liczby komórek w zawiesinie, ekspresji białek zielonej i czerwonej fluorescencji, żywotności komórek, apoptozy i cyklu komórkowego w próbach o objętości 25 µl. Licznik może być używany do różnego typu komórek eukariotycznych.

TERMOCYKLER MIC DO REAL-TIME PCR
Termocykler MIC (Bio Molecular Systems, Upper Coomera, Australia) do analizy ekspresji genów metodą real-time PCR, oparty na technologii indukcji magnetycznej, model 4-kanałowy, z systemem rotorowym na 48 prób zapewniającym stałą drogę optyczną, jednorodność temperatury i dokładność. Umożliwia przeprowadzenie PCR w objętości reakcyjnej od 10 do 25 µl.
INKUBATOR CO2 MIDI 40
Inkubator CO2 MIDI 40 (Thermo Scientific, Waltham, Massachusetts, USA) do hodowli komórkowych zapewniający odpowiednie stężenie CO2, wilgotność powietrza i temperaturę, z płaszczem powietrznym i komorą roboczą ze stali nierdzewnej o pojemności 40 l. Inkubator przeznaczony do krótko-terminowych hodowli limfocytów (testy proliferacji).


AUTOMATYCZNY MIKROTOM ROTACYJNY HM355S
Automatyczny mikrotom rotacyjny HM355S (Thermo Shandon Limited, Runcorn, UK) z systemem transferu skrawków (STS) po torze wodnym i przystawką chłodzącą Cool-Cut do precyzyjnego cięcia materiału biologicznego zatopionego w bloczkach parafinowych. Mikrotom umożliwia uzyska-nie preparatów histologicznych o grubości od 0,5 do 100 µm. System Cool-Cut utrzymuje przez długi czas niską tempera-turę bloczku parafinowego w uchwycie i wraz z STS zapewnia maksymalną elastyczność skrawków.
SUSZARKA FN500
Suszarka FN500 (Nüve, Ankara, Turkey) o pojemności użytkowej 110 l, z wymuszonym obiegiem powietrza zapewniającym wysoką jednorodność i stabilność temperatury w komorze, sterowana mikroprocesorowo. Zakres temperatury: od +5°C powyżej temperatury otoczenia do 250°C. Wykorzystywana do suchej sterylizacji narzędzi, suszenia preparatów histologicznych oraz inkubacji prób w czasie analiz.

Kontakt:
Instytut Fizjologii i Żywienia Zwierząt im. Jana Kielanowskiego Polskiej Akademii Nauk
ul. Instytucka 3, 05-110 Jabłonna
dr inż. Marcin Barszcz
🖂 m.barszcz@ifzz.pl; tel. 22 765 33 00; 22 765 33 30

